
المحتوى
- الامتحان البدني والتاريخ
- تحاليل الدم
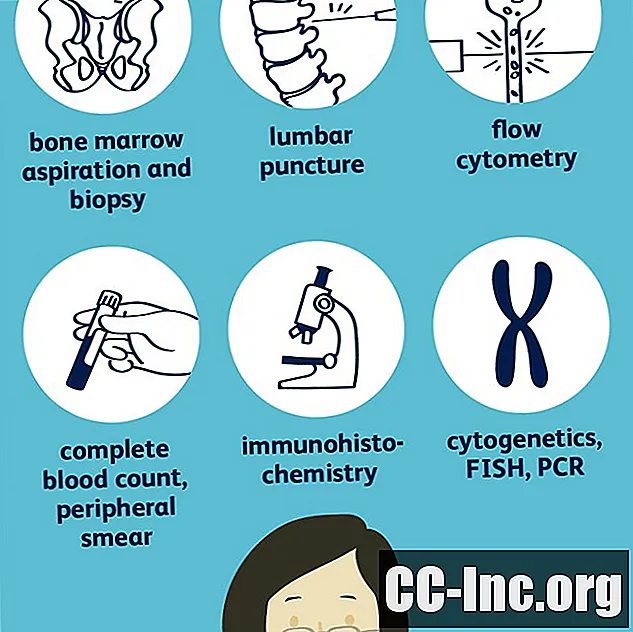
- شفط وخزعة نخاع العظم
- الكيمياء الخلوية
- دراسات الكروموسوم والجينات
- إجراءات أخرى
- التصوير
- تشخيص متباين
- انطلاق
يتم بعد ذلك إجراء اختبارات إضافية للبحث عن العلامات السطحية على الخلايا (قياس التدفق الخلوي) بالإضافة إلى التغيرات الجينية (اختبار الوراثة الخلوية). مع بعض أنواع اللوكيميا ، يمكن الاطلاع على البزل القطني (البزل الشوكي) أو خزعة العقدة الليمفاوية أيضًا.
إذا تم اكتشاف السرطان ، فسيتم تنظيمه بناءً على عوامل مثل الأعراض ، والنوع الفرعي لسرطان الدم ، وعدد الخلايا غير الطبيعية في الدم أو نخاع العظام ، وأكثر من ذلك.
عند الحديث عن تشخيص سرطان الدم ، من المهم أن تتذكر أن سرطان الدم ليس مرضًا واحدًا أو حتى أربعة أمراض. بدلا من ذلك ، هناك العديد من الاختلافات المختلفة.
قد يتصرف نوعان من ابيضاض الدم يظهران متطابقين تحت المجهر بشكل مختلف تمامًا ، وقد تساعد بعض الاختبارات أدناه في تمييز بعض الاختلافات.
الامتحان البدني والتاريخ
التاريخ والجسم هما نقطة البداية في تشخيص اللوكيميا وما يدفع الأطباء في كثير من الأحيان إلى طلب مزيد من الدراسات ، ولكن لا يمكن استخدامها بمفردها لإجراء التشخيص.
في حالة الاشتباه في الإصابة بسرطان الدم ، سيسألك طبيبك عن أي أعراض لسرطان الدم وعوامل الخطر للمرض الذي قد تكون لديك. قد يكشف الفحص البدني عن علامات على وجود سرطان الدم ، مثل تورم الغدد الليمفاوية أو شحوب الجلد أو كدمات. وعلى الرغم من أنها ملحوظة في حالة وجودها ، إلا أنها قد تشير إلى مخاوف أخرى. سيأخذ طبيبك في الاعتبار وجودهم.
دليل مناقشة طبيب اللوكيميا
احصل على دليلنا القابل للطباعة لموعد طبيبك التالي لمساعدتك في طرح الأسئلة الصحيحة.

تحاليل الدم
يمكن أن يعطي كل من تعداد الدم الكامل واللطاخة المحيطية ، واختبارات الدم البسيطة ، أدلة مهمة فيما يتعلق بتشخيص ونوع سرطان الدم ، وتوجيه المزيد من التقييم.
العد الكامل لخلايا الدم ومسحة الدم المحيطية
أتعداد الدم الكامل (CBC) يقيس عدد كل نوع من أنواع خلايا الدم الرئيسية التي يصنعها نخاع العظام: خلايا الدم البيضاء وخلايا الدم الحمراء والصفائح الدموية. يمكن أن ينتج عن CBC أيضًا نتائج تنقل معلومات مهمة حول هذه الخلايا ، مثل ما إذا كانت خلايا الدم الحمراء كبيرة أم صغيرة.
في حين أن هناك غالبًا زيادة في خلايا الدم البيضاء المصابة بسرطان الدم ، إلا أنه في بعض الأحيان يوجد سرطان الدم الحاد تخفيض في جميع أنواع خلايا الدم ، وهي حالة يشار إليها باسم قلة الكريات الشاملة.
أ مسحة محيطية هو اختبار مهم للغاية عند التفكير في تشخيص سرطان الدم. في اللطاخة المحيطية ، يتم نشر عينة من الدم على شريحة مجهرية وتضاف صبغة. ثم يتم تقييم اللطاخة تحت المجهر.
يمكن لـ CBC تحديد ما إذا كان عدد خلايا الدم البيضاء منخفضًا أم مرتفعًا ، لكنه لا يعطي معلومات كافية حول نوع خلايا الدم البيضاء التي تزداد أو تنقص.
كما أنه لا يخبر الطبيب ما إذا كانت هناك خلايا دم بيضاء غير ناضجة تسمى "أرومات" في خلايا الدم المحيطية والتي توجد عادة بأعداد كبيرة فقط في نخاع العظام.
يمكن أن تجيب اللطاخة المحيطية على هذه الأسئلة من خلال السماح للفنيين والأطباء بمراقبة الخلايا مباشرة تحت المجهر.
النتائج النموذجية (يمكن أن تختلف) على CBC ومسحة الدم للأنواع الأربعة الرئيسية من سرطان الدم تشمل:
مرض | نتائج CBC | نتائج مسحة الدم |
ابيضاض الدم النقوي الحاد (AML) | كميات أقل من المعتاد من خلايا الدم الحمراء والصفائح الدموية | العديد من الخلايا البيضاء غير الناضجة ، وأحيانًا وجود قضبان Auer |
ابيضاض الدم الليمفاوي الحاد (الكل) | كميات أقل من المعتاد من خلايا الدم الحمراء والصفائح الدموية | العديد من الخلايا البيضاء غير الناضجة |
ابيضاض الدم النقوي المزمن (CML) | • قد يكون عدد خلايا الدم الحمراء مرتفعًا وقد يكون عدد الصفائح الدموية مرتفعًا أو منخفضًا | • قد تظهر بعض الخلايا البيضاء غير الناضجة |
ابيضاض الدم الليمفاوي المزمن (CLL) | • قد تنخفض خلايا الدم الحمراء والصفائح الدموية وقد لا تنخفض | • قلة أو عدم وجود خلايا بيضاء غير ناضجة |
يمكن أيضًا إجراء بعض الاختبارات الموضحة أدناه ، مثل كيمياء الخلايا ، على الدم المحيطي.
شفط وخزعة نخاع العظم
في معظم أنواع اللوكيميا ، لا تكفي اختبارات الدم لتشخيص المرض بشكل قاطع ، ويتم إجراء شفط وخزعة من نخاع العظم. (مع CLL ، يمكن أحيانًا إجراء التشخيص بناءً على اختبارات الدم أعلاه ، ولكن يمكن أن يظل نخاع العظم مفيدًا في تحديد مدى تقدم السرطان.) نخاع العظم هو مصدر الخلايا السرطانية في سرطان الدم وجميع خلايا الدم الموجودة في الدم المحيطي.
مع شفط نخاع العظم ، يتم إدخال إبرة رفيعة وطويلة في نخاع العظم في الورك (أو في بعض الأحيان عظم القص) بعد تخدير الجلد محليًا باستخدام يدوكائين. بعد سحب عينة من النخاع العظمي ، يتم أيضًا أخذ عينة خزعة.
في نخاع العظم الطبيعي ، ما بين 1 في المائة و 5 في المائة من الخلايا عبارة عن خلايا أرومية ، أو خلايا الدم البيضاء غير الناضجة التي تنضج لتصبح تلك الموجودة عادة في الدم.
يمكن إجراء تشخيص لـ ALL إذا كان 20٪ على الأقل من الخلايا عبارة عن أرومات (أرومات ليمفاوية). مع AML ، يمكن إجراء التشخيص إذا كان هناك أقل من 20٪ من الانفجارات (الأرومات النخاعية) إذا تم العثور أيضًا على تغيير محدد في الكروموسوم.
بالإضافة إلى النظر في عدد الخلايا المختلفة الموجودة في نخاع العظم ، ينظر الأطباء أيضًا إلى نمط الخلايا. على سبيل المثال ، مع CLL ، يكون تشخيص المرض أفضل إذا تم العثور على الخلايا السرطانية في مجموعات (نمط عقدي أو خلالي) مما لو تم العثور عليها منتشرة حول نخاع العظام.
يمكن أن تكون نسبة خلايا سرطان الدم إلى الخلايا السليمة المكونة للدم مهمة في عملية التشخيص.
الكيمياء الخلوية
تبحث الكيمياء الخلوية في كيفية امتصاص الخلايا الموجودة في نخاع العظام لبعض البقع ويمكن أن تساعد في التمييز بين ALL من AML. يمكن أن تشمل الاختبارات كلاً من قياس التدفق الخلوي والكيمياء النسيجية المناعية.
في التدفق الخلوي، خلايا نخاع العظام (أو خلايا الدم المحيطية) مغلفة بأجسام مضادة للبحث عن وجود بروتينات معينة موجودة على سطح الخلايا. ستلتصق الأجسام المضادة بهذه البروتينات ويمكن اكتشافها بالضوء الذي تصدره عند إدخال الليزر.
المناعية مشابه ، ولكن بدلاً من استخدام الليزر للبحث عن الضوء المنبعث من البروتينات التي تحمل علامات الأجسام المضادة ، يمكن رؤيتها تحت المجهر بسبب تغير اللون.
يشار إلى عملية البحث عن بروتينات فريدة على سطح الخلايا باسم التنميط المناعي. في علم الوراثة ، يشير النمط الجيني إلى خصائص الجين ، بينما يصف النمط الظاهري الخصائص الفيزيائية (مثل العيون الزرقاء). تختلف الأنواع المختلفة من سرطان الدم في هذه الأنماط الظاهرية.
في حالات اللوكيميا الحادة (كل من ALL و AML) ، يمكن أن تكون هذه الدراسات مفيدة في تحديد النوع الفرعي للمرض ، ويمكن مع ALL ، تحديد ما إذا كان سرطان الدم يتضمن الخلايا التائية أو الخلايا البائية.
بالإضافة إلى ذلك ، يمكن أن تكون هذه الاختبارات مفيدة جدًا في تأكيد تشخيص CLL (من خلال البحث عن بروتينات تسمى ZAP-70 و CD38).
يمكن أيضًا استخدام قياس التدفق الخلوي لتحديد كمية الحمض النووي في خلايا سرطان الدم ، مما قد يكون مفيدًا في التخطيط للعلاج. تميل جميع الخلايا التي تحتوي على حمض نووي أكثر من الخلية العادية إلى الاستجابة بشكل أفضل للعلاج الكيميائي.
دراسات الكروموسوم والجينات
غالبًا ما يكون لخلايا اللوكيميا تغييرات في الكروموسومات أو الجينات الموجودة في الحمض النووي لكل خلية. تحتوي كل خلية من خلايانا عادةً على 46 كروموسومًا ، 23 من كل والد ، تحتوي على العديد من الجينات. تبحث بعض الدراسات بشكل أساسي في التغيرات الكروموسومية ، بينما تبحث دراسات أخرى عن التغيرات في جينات معينة.
علم الوراثة الخلوية
يتضمن علم الوراثة الخلوية فحص كروموسومات الخلايا السرطانية تحت المجهر والبحث عن التشوهات.
نظرًا للطريقة التي يتم بها ذلك (تحتاج الخلايا السرطانية إلى وقت للنمو في المختبر بعد استرجاعها) ، غالبًا ما لا تتوفر نتائج هذه الدراسات لمدة أسبوعين إلى ثلاثة أسابيع بعد إجراء خزعة نخاع العظم.
تشمل التغيرات الكروموسومية التي يمكن رؤيتها في خلايا سرطان الدم ما يلي:
- عمليات الحذف: جزء من الكروموسوم مفقود.
- النقل: يتم تبادل قطع من اثنين من الكروموسومات. قد يكون هذا تبادلًا كاملاً ، حيث يتم ببساطة تبادل قطع من الحمض النووي بين اثنين من الكروموسومات ، أو جزئيًا. على سبيل المثال ، يمكن تبديل الحمض النووي بين الكروموسومات 9 و 22. تعتبر عمليات نقل الكروموسومات شائعة جدًا في سرطان الدم ، حيث تحدث في ما يصل إلى 50 بالمائة من هذه السرطانات.
- الانعكاس: يظل جزء من الكروموسوم موجودًا ، ولكن يتم استدارته (كما لو تم إزالة قطعة من اللغز واستبدالها ، ولكن للخلف).
- الإضافة أو التكرار: تم العثور على نسخ إضافية من كل أو جزء من الكروموسوم.
- التثلث الصبغي: توجد ثلاث نسخ من أحد الكروموسومات بدلاً من نسختين.
بالإضافة إلى تحديد نوع سرطان الدم بشكل أكبر ، يمكن أن تساعد الوراثة الخلوية في التخطيط للعلاج. على سبيل المثال ، في حالات سرطان الدم ALL ، تستجيب خلايا سرطان الدم التي تحتوي على أكثر من 50 كروموسومًا بشكل أفضل للعلاج.
تهجين الفلورسنت في الموقع (FISH)
التهجين الفلوري في الموقع (FISH) هو إجراء يستخدم صبغات خاصة للبحث عن التغيرات في الكروموسومات التي لا يمكن اكتشافها تحت المجهر ، أو التغيرات في جينات معينة.
يمكن أن يبحث هذا الاختبار عن ابيضاض الدم النقوي المزمن (CML) قطع لجين الاندماج BCR / ABL1 (كروموسوم فيلادلفيا).
ما يقرب من 95 ٪ من الأشخاص المصابين بسرطان الدم النخاعي المزمن سيحصلون على هذا الكروموسوم 22 المختصر ، لكن 5 ٪ المتبقية سيظل لديهم جين الانصهار غير الطبيعي BCR / ABL1 في مزيد من الاختبارات. يعتبر كروموسوم فيلادلفيا أيضًا اكتشافًا مهمًا مع ALL.
مع CLL ، تكون الوراثة الخلوية أقل فائدة ، كما أن FISH و PCR أكثر أهمية في إيجاد التغيرات الجينية.هناك العديد من التشوهات الجينية التي يمكن رؤيتها في هذه الدراسات ، بما في ذلك عمليات الحذف في الذراع الطويلة للكروموسوم 13 (في نصف المصابين بالمرض) ، ونسخة إضافية من الكروموسوم 12 (التثلث الصبغي 12) ، والحذف في اليومين السابع عشر والحادي عشر. كروموسوم وطفرات معينة في الجينات مثل NOTCH1 و SF3B1 والمزيد.
تفاعل البلمرة المتسلسل (PCR)
مثل FISH ، يمكن أن يجد تفاعل البلمرة المتسلسل (PCR) تغييرات في الكروموسومات والجينات التي لا يمكن رؤيتها من خلال علم الوراثة الخلوية. يساعد تفاعل البوليميراز المتسلسل أيضًا في إيجاد التغييرات الموجودة في عدد قليل فقط من الخلايا السرطانية ، ولكن ليس كلها.
يعتبر تفاعل البوليميراز المتسلسل حساسًا جدًا في العثور على جين BCR / ABL ، حتى عندما لا يتم العثور على علامات أخرى لـ CML في اختبار الكروموسوم.
إجراءات أخرى
بالإضافة إلى تقييم خلايا الدم البيضاء في الدم ونخاع العظام ، تُجرى أحيانًا إجراءات أخرى.
البزل القطني (Spinal Tap)
في بعض أنواع اللوكيميا ، يمكن إجراء البزل النخاعي (البزل القطني) للبحث عن وجود خلايا سرطان الدم التي انتشرت في السائل المحيط بالدماغ والحبل الشوكي. ويمكن إجراؤها أيضًا لمن لديهم ALL ، كأشخاص مصابين بابيضاض الدم النقوي الحاد ولديهم أي أعراض عصبية تشير إلى هذا الانتشار.
في البزل القطني ، يستلقي الشخص على طاولة على جانبه وركبتيه لأعلى ورأسه لأسفل. بعد تنظيف المنطقة وتخديرها ، يقوم الطبيب بإدخال إبرة رفيعة طويلة في أسفل الظهر ، وبين الفقرات ، وفي الفراغ المحيط بالنخاع الشوكي. ثم يتم سحب السائل وإرساله إلى أخصائي علم الأمراض لتحليله.
خزعة العقدة الليمفاوية
يتم إجراء خزعات العقدة الليمفاوية ، التي يتم فيها إزالة جزء أو كل العقدة الليمفاوية ، بشكل غير متكرر مع سرطان الدم. يمكن إجراء خزعة العقدة الليمفاوية باستخدام CLL في حالة وجود العقد الليمفاوية الكبيرة ، أو إذا كان يعتقد أن CLL قد تحول إلى سرطان الغدد الليمفاوية.
التصوير
لا تُستخدم اختبارات التصوير عادةً كطريقة تشخيصية لسرطان الدم ، لأن السرطانات المرتبطة بالدم مثل اللوكيميا لا تشكل غالبًا أورامًا. ومع ذلك ، قد يكون مفيدًا في تنظيم بعض أنواع اللوكيميا ، مثل CLL.
الأشعة السينية
لا تُستخدم الأشعة السينية ، مثل تصوير الصدر بالأشعة السينية أو الأشعة السينية للعظام لتشخيص اللوكيميا ، ولكنها قد تعطي العلامات الأولى على وجود خطأ ما. قد تظهر الأشعة السينية تضخمًا في الغدد الليمفاوية أو ترققًا في العظام (هشاشة العظام).
التصوير المقطعي (CT Scan)
يستخدم التصوير المقطعي المحوسب سلسلة من الأشعة السينية لإنشاء صورة ثلاثية الأبعاد لداخل الجسم. قد يكون التصوير المقطعي المحوسب مفيدًا في النظر إلى العقد الموجودة في الصدر أو مناطق أخرى من الجسم ، بالإضافة إلى ملاحظة تضخم الطحال أو الكبد.
التصوير بالرنين المغناطيسي (مري)
يستخدم التصوير بالرنين المغناطيسي مغناطيسًا لإنشاء صورة لداخل الجسم ولا ينطوي على إشعاع. قد يكون مفيدًا في حالات اللوكيميا التي تشمل الدماغ أو النخاع الشوكي.
التصوير المقطعي بالإصدار البوزيتروني (PET / CT أو PET / MRI)
في فحص التصوير المقطعي بالإصدار البوزيتروني ، يتم حقن الجلوكوز المشع في الجسم ، حيث يتم امتصاصه بواسطة الخلايا الأكثر نشاطًا في التمثيل الغذائي (مثل الخلايا السرطانية). يُعد التصوير المقطعي بالإصدار البوزيتروني مفيدًا في حالة الأورام الصلبة أكثر من سرطان الدم ، ولكنه قد يكون مفيدًا في بعض حالات اللوكيميا المزمنة ، خاصة عندما يكون هناك قلق بشأن التحول إلى سرطان الغدد الليمفاوية.
تشخيص متباين
هناك بعض الأمراض التي قد تشبه سرطان الدم ، على الأقل مع الاختبارات الأولية. بعض هذه تشمل:
- بعض أنواع العدوى الفيروسية: على سبيل المثال ، قد يتسبب فيروس Epstein-Barr (سبب كثرة كريات الدم البيضاء المعدية) والفيروس المضخم للخلايا وفيروس نقص المناعة البشرية في زيادة عدد الخلايا الليمفاوية غير النمطية في اختبارات الدم.
- متلازمات خلل التنسج النقوي: هي أمراض تصيب نخاع العظم لديها ميل للتطور إلى سرطان الدم النخاعي المزمن ويشار إليها أحيانًا باسم prelukemia.
- اضطرابات التكاثر النقوي: قد تشبه حالات مثل كثرة الحمر الحقيقية وكثرة الصفيحات الأساسية والتليف النقوي الأولي وغير ذلك سرطان الدم قبل أداء طرق الاختبار المتعمق أعلاه.
- فقر الدم اللاتنسجي: حالة يتوقف فيها نخاع العظم عن تكوين جميع أنواع خلايا الدم.
انطلاق
بمجرد تأكيد الإصابة بسرطان الدم ، يجب أن يتم تنظيمه. يشير التدريج إلى النظام الذي يستخدمه الأطباء لتصنيف السرطان. يمكن أن يساعد تحديد مرحلة السرطان ، بشكل عام ، الأطباء في اختيار العلاج الأنسب بالإضافة إلى تقدير تشخيص المرض.
يختلف التدريج بين الأنواع المختلفة لسرطان الدم. نظرًا لأن العديد من اللوكيميا لا تشكل كتلًا صلبة ، فإن التدريج (باستثناء سرطان الدم الليمفاوي المزمن) يختلف تمامًا عن الأورام الصلبة مثل سرطان الثدي أو سرطان الرئة.
يمكن أخذ عدد من الدراسات في الاعتبار عند تحديد المرحلة ، مثل عدد خلايا الدم البيضاء غير الناضجة الموجودة في الدم أو نخاع العظام ، وعلامات الورم ، ودراسات الكروموسوم ، وغير ذلك.
عند النظر إلى التصنيف المرحلي ، من المهم مرة أخرى ملاحظة أن اللوكيميا هي مجموعة واسعة من الأمراض. قد يكون لشخصين مصابين بنفس النوع من سرطان الدم ونفس المرحلة استجابات مختلفة جدًا للعلاج ، بالإضافة إلى تنبؤات مختلفة.
ابيضاض الدم الليمفاوي المزمن (CLL)
بالنسبة لسرطان الدم الليمفاوي المزمن ، هناك عدد من أنظمة التدريج المختلفة التي يمكن استخدامها. الأكثر شيوعًا هو نظام الراي. في هذا النظام ، يتم إعطاء اللوكيميا مرحلة ما بين المرحلة 0 والمرحلة 4 بناءً على وجود عدة نتائج:
- أعداد كبيرة من الخلايا الليمفاوية
- تضخم الغدد الليمفاوية
- تضخم الكبد و / أو الطحال
- فقر دم
- مستويات منخفضة من الصفائح الدموية
بناءً على هذه المراحل ، يتم بعد ذلك تقسيم السرطانات إلى فئات منخفضة ومتوسطة وعالية الخطورة.
في المقابل ، يفصل نظام Binet المستخدم في أوروبا سرطان الدم إلى ثلاث مراحل فقط:
- المرحلة أ: أقل من 3 عقد ليمفاوية
- المرحلة ب: أكثر من 3 غدد ليمفاوية مصابة
- المرحلة ج: أي عدد من الغدد الليمفاوية ، ولكن مقترنة إما بفقر الدم أو انخفاض مستوى الصفائح الدموية.
ابيضاض الدم الليمفاوي الحاد (الكل)
لسرطان الدم الليمفاوي الحاد, يختلف التدريج ، لأن المرض لا يشكل كتل ورم تمتد تدريجياً من الورم الأصلي.
من المحتمل أن ينتشر ALL إلى أعضاء أخرى حتى قبل اكتشافه ، لذلك بدلاً من استخدام طرق التصنيف التقليدية ، غالبًا ما يأخذ الأطباء في الاعتبار النوع الفرعي من ALL وعمر الشخص.
يتضمن هذا عادةً اختبارات وراثية خلوية وقياس التدفق الخلوي واختبارات معملية أخرى.
بدلاً من استخدام المراحل (تلك المستخدمة في الماضي عفا عليها الزمن إلى حد كبير) ، يتم تعريف ALL في كثير من الأحيان من خلال "مراحل" المرض. وتشمل هذه:
- غير المعالجة ALL
- الكل في مغفرة
- الحد الأدنى من المرض المتبقي
- حرارية ALL
- منتكس (متكرر) ALL
ابيضاض الدم النقوي الحاد (AML)
على غرار ALL ، لا يتم عادةً اكتشاف ابيضاض الدم النقوي الحاد حتى ينتشر إلى أعضاء أخرى ، وبالتالي لا يمكن تطبيق تصنيف السرطان التقليدي. يتم تحديد التدريج من خلال خصائص مثل النوع الفرعي لسرطان الدم وعمر الشخص وغير ذلك.
صنف نظام التدريج الأقدم ، التصنيف الفرنسي الأمريكي البريطاني (FAB) ، AML إلى ثمانية أنواع فرعية ، من M0 إلى M7 ، بناءً على مظهر الخلايا تحت المجهر.
طوّرت منظمة الصحة العالمية (WHO) نظامًا مختلفًا لتحديد مراحل AML على أمل التنبؤ عن كثب بتكهن المرض.
في هذا النظام ، يتم فصل اللوكيميا عن طريق خصائص مثل تشوهات الكروموسومات في الخلايا (ترتبط بعض التغييرات الصبغية بتشخيص أفضل من المتوسط ، بينما يرتبط البعض الآخر بنتائج أسوأ) ، سواء نشأ السرطان بعد العلاج الكيميائي السابق أو الإشعاع (السرطانات الثانوية) ، وتلك المتعلقة بمتلازمة داون ، وأكثر من ذلك.
ابيضاض الدم النقوي المزمن (CML)
بالنسبة لسرطان الدم النخاعي المزمن ، يعد وجود عدد متزايد من الخلايا الناضجة التي تنتمي إلى سلالة النخاع الشوكي (مثل العدلات) أمرًا شائعًا. يتم تحديد التدريج بناءً على عدد الخلايا النخاعية غير الناضجة في مراحل النضج المختلفة:
- المرحلة المزمنة: في هذه المرحلة المبكرة ، يوجد أقل من 10 في المائة من النفخات في الدم أو نخاع العظام وتكون الأعراض إما خفيفة أو غائبة. عادةً ما يستجيب الأشخاص في المرحلة المزمنة من سرطان الدم النخاعي المزمن للعلاج جيدًا.
- المرحلة المتسارعة: في المرحلة التالية ، 10٪ إلى 20٪ من خلايا الدم أو نخاع العظام هي عبارة عن خلايا. تصبح الأعراض أكثر وضوحًا ، وخاصة الحمى وفقدان الوزن. قد يكشف الاختبار عن تغيرات كروموسومية جديدة بالإضافة إلى كروموسوم فيلادلفيا. قد لا يستجيب الأشخاص في المرحلة المتسارعة من سرطان الدم النخاعي المزمن للعلاج.
- مرحلة الانفجار (المرحلة العدوانية): في مرحلة انفجار سرطان الدم النخاعي المزمن ، يكون أكثر من 20 في المائة من الخلايا في الدم أو نخاع العظام عبارة عن خلايا ، وقد تنتشر خلايا الانفجار أيضًا إلى مناطق من الجسم خارج نخاع العظام. خلال هذه المرحلة ، تشمل الأعراض التعب والحمى وتضخم الطحال (أزمة الانفجار).